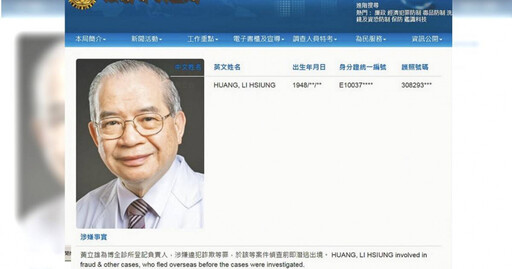
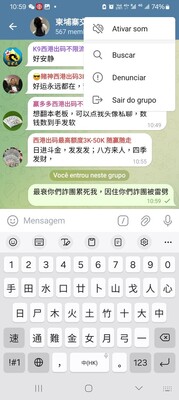
人氣話題
猜你喜歡
個人化商品推薦
關
開
本日嚴選HOT PICK